TEMA 2 UNIDAD 3
Concentraciones
A diferencia de lo que ocurre con las sustancias “puras”, la composición de una mezcla es variable. Si la composición de una mezcla se modifica, también se modifican de ebullición El agua de limón ejemplifica este hecho, pues una limonada ( modifica con la preparada.
.
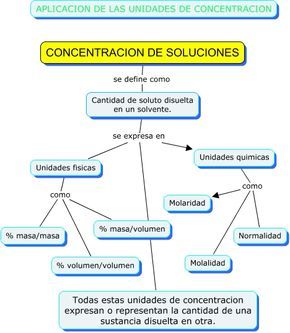
Concentración porcentual
Debido a la reacción o transformación química la masa permanece invariante (Ley de la conservación de la masa), podemos saber que la masa del soluto + la masa del disolvente = masa de la mezcla.
Concentración Molar o Molaridad
Esta unidad de concentración es una de las más empleadas en química y se define como la cantidad de moles de soluto contenidas en 1 L de disolución (mezcla). Nota que para preparar 1 L de una disolución acuosa 1 M de Na2SO4 debemos colocar 1 mol de soluto en un matraz aforado (de 1L) y agregar agua (cuanta sea necesaria) hasta la marca del aforo del matraz. En esta unidad de concentración la cantidad de disolvente empleada está indeterminada pues para preparar 1 L de una disolución 1M es claro que emplearemos menos de 1 L de disolvente.