TEMA 3 UNIDAD 5
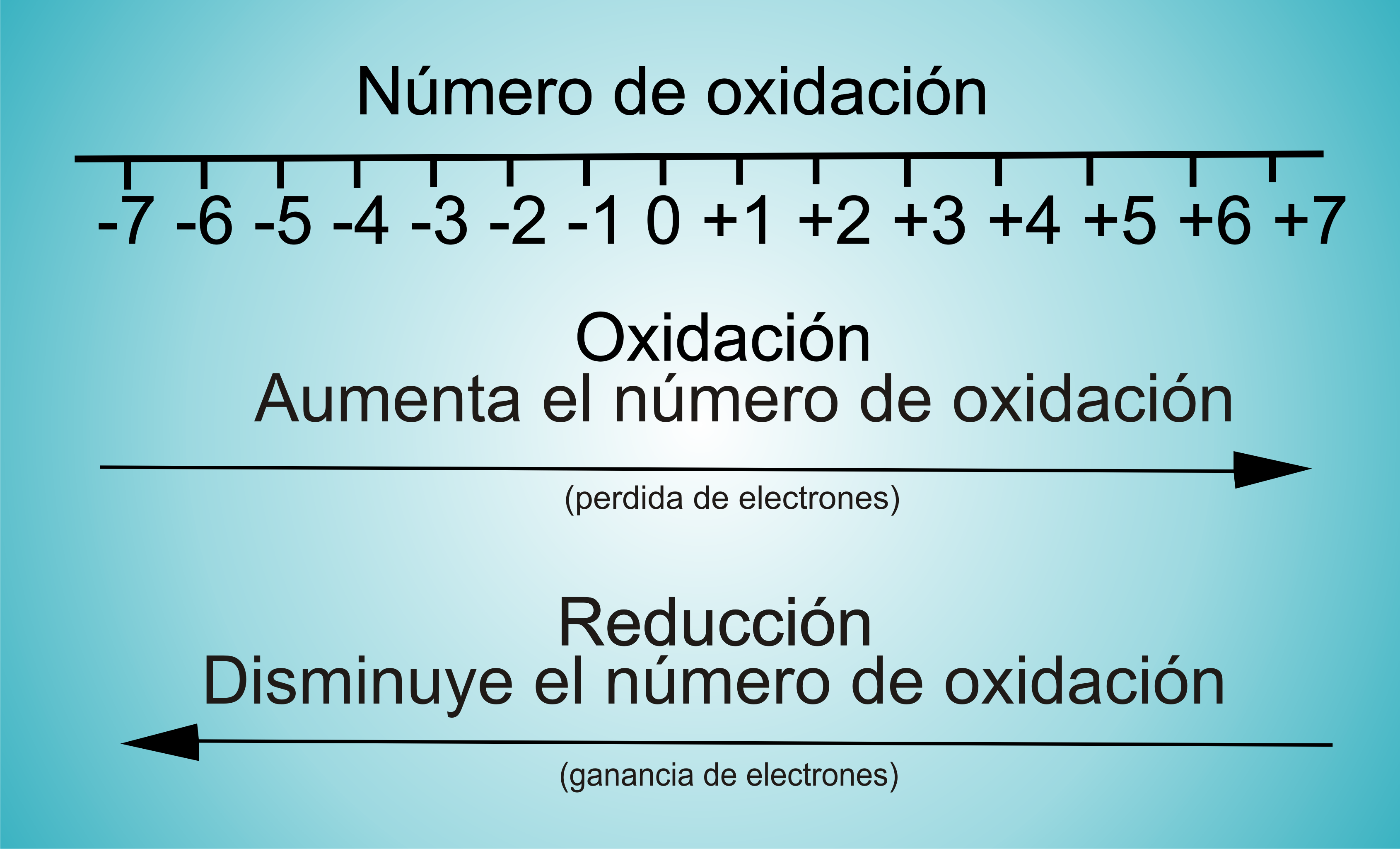
Leyes del Método redox
Para el equilibrio de las reacciones químicas se realiza correctamente, se debe prestar atención a los siguientes principios.
Primer Ley
ley de conservación de la masa : Esta ley establece que la suma de las masas de todos los reactivos debe ser siempre igual a la suma de las masas de todos los productos (principio de Lavoisier).
Segunda Ley
Ley de las proporciones definidas : Los productos de una reacción se proporcionan con una relación proporcional de la masa con los reactivos. Por lo tanto, si reaccionar con 12 g de carbono 36g 48g de oxígeno para formar dióxido de carbono , el carbono reacciona con el oxígeno de 6 g 18 g 24 g para formar dióxido de carbono.