TEMA 3 UNIDAD 2
Teoría de la repulsión.
El modelo de repulsión de los pares electrónicos de la capa de valencia parte de una idea intuitiva y sencilla: dado que los electrones son cargas negativas y se repelen entre sí, la geometría de la especie química considerada será aquella que permita minimizar las repulsiones entre los pares electrónicos que se hallan en torno al átomo central, es decir, los electrones de la capa de valencia del átomo central. Estos pares electrónicos pueden ser tanto pares pertenecientes a un enlace químico con otro átomo (pares enlazantes) como pares libres (pares no enlazantes). Así, estos pares electrónicos en torno al átomo central se colocarán lo más separados posible para que la repulsión entre ellos sea mínima.
Cabe destacar, no obstante, que los pares no enlazantes causan mayores repulsiones a lo pares vecinos que los pares enlazantes, motivo por el cual algunas moléculas con pares libres en torno al átomo central, como el amoniaco o el agua, presentan ligeras variaciones en el ángulo de enlace esperado. Puesto que nos basamos en la capa de valencia del átomo central, el modelo RPECV es útil únicamente para la predicción de la geometría de moléculas covalentes sencillas, formadas por un átomo central enlazado a algunos átomos periféricos.
En función del número de pares de electrones (enlazantes o no enlazantes) en torno al átomo central, estos pares se dispondrán de la forma siguiente:
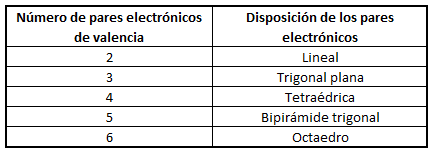
Esta teoría tiene relación con la de la hibridación de orbitales porque también esta última tiene implicaciones geométricas. Así por ejemplo, la hibridación sp3 supone la formación de un tetraedro porque los cuatro enlaces híbridos sp3 tienden a colocarse lo más lejos posible angularmente unos de otros.