TEMA 4 UNIDAD 3
Modelos de hibridaciones.
Para establecer la hibridación de un átomo en una molécula, se requiere conocer la estructura de Lewis de la misma y con base en ella se desarrollan los pasos siguientes:
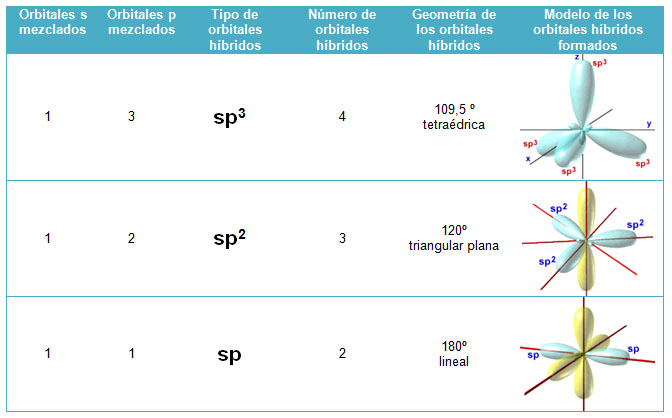 La teoría de hibridación de orbitales, establecida por Linus Pauling en su obra publicada en 1931 The Nature of the Chemical Bond, complementa la teoría de enlace de valencia a la hora de explicar la formación de enlaces covalentes. En concreto, la hibridación es el mecanismo que justifica la distribución espacial de los pares de electrones de valencia (lineales, triangulares planas y tetraédricas). Los tipos de hibridación de orbitales que necesitamos aplicar para justificar la geometría de las moléculas más simples son: sp, sp2 y sp3.
Las ideas básicas que permiten una primera aproximación al modelo de hibridación son:
Un orbital híbrido es una combinación de orbitales atómicos
El número de orbitales híbridos que se forman es igual al número de orbitales atómicos que se combinan.
Los orbitales híbridos formados tienen la misma forma y una determinada orientación espacial: sp lineal; sp2 triangular plana y sp3 tetraédrica.
Los orbitales híbridos disponen de una zona o lóbulo enlazante y otra zona o lóbulo antienlazante; el enlace se produce por el solapamiento del lóbulo enlazante con el otro orbital del átomo a enlazar.
La teoría de hibridación de orbitales, establecida por Linus Pauling en su obra publicada en 1931 The Nature of the Chemical Bond, complementa la teoría de enlace de valencia a la hora de explicar la formación de enlaces covalentes. En concreto, la hibridación es el mecanismo que justifica la distribución espacial de los pares de electrones de valencia (lineales, triangulares planas y tetraédricas). Los tipos de hibridación de orbitales que necesitamos aplicar para justificar la geometría de las moléculas más simples son: sp, sp2 y sp3.
Las ideas básicas que permiten una primera aproximación al modelo de hibridación son:
Un orbital híbrido es una combinación de orbitales atómicos
El número de orbitales híbridos que se forman es igual al número de orbitales atómicos que se combinan.
Los orbitales híbridos formados tienen la misma forma y una determinada orientación espacial: sp lineal; sp2 triangular plana y sp3 tetraédrica.
Los orbitales híbridos disponen de una zona o lóbulo enlazante y otra zona o lóbulo antienlazante; el enlace se produce por el solapamiento del lóbulo enlazante con el otro orbital del átomo a enlazar.